Conceptos en Química
¿Qué es el Mezcla?
Una mezcla es la combinación de dos o más sustancias que se unen físicamente, pero no químicamente. En una mezcla, las sustancias conservan sus propiedades originales y pueden separarse por métodos físicos. Las mezclas se dividen en dos tipos principales:
A diferencia de los compuestos químicos, en las mezclas no hay una reacción química entre los componentes.
Ejemplos:
Aquí tienes una lista de ejemplos comunes de mezclas, que incluyen tanto mezclas homogéneas como heterogéneas:
1. Agua y sal – Solución salina (homogénea).
2. Arena y grava – Mezcla de partículas visibles (heterogénea).
3. Leche (homogeneizada) – Mezcla uniforme de agua, grasa y sólidos (homogénea).
4. Aceite y agua – Dos líquidos que no se mezclan (heterogénea).
5. Cereal con leche – Trozos de cereal visibles en la leche (heterogénea).
6. Aire – Mezcla de gases como nitrógeno, oxígeno y dióxido de carbono (homogénea).
7. Sopa de verduras – Trozos de vegetales en el caldo (heterogénea).
8. Jugo de naranja (sin pulpa) – Mezcla uniforme de jugo (homogénea).
9. Granito – Roca compuesta por varios minerales visibles (heterogénea).
10. Concreto – Mezcla de cemento, agua, arena y grava (heterogénea).
11. Bebidas gaseosas – Mezcla uniforme de agua, azúcar y dióxido de carbono (homogénea).
12. Barro – Mezcla de agua y tierra (heterogénea).
13. Mezcla de frutos secos – Diferentes tipos de nueces y semillas (heterogénea).
14. Cerveza – Mezcla uniforme de agua, lúpulo, cebada y levadura (homogénea).
15. Granola – Mezcla de avena, nueces y frutas secas (heterogénea).
16. Sangre – Mezcla de células y plasma (heterogénea).
17. Gelatina con frutas – Trozos de fruta visibles en la gelatina (heterogénea).
18. Solución de ácido clorhídrico – Compuesto homogéneo en agua (homogénea).
19. Frutas en almíbar – Frutas visibles en jarabe (heterogénea).
20. Mezcla de aceites esenciales – Diferentes aceites aromáticos (homogénea).
21. Nieve y tierra – Combinación visible (heterogénea).
22. Polvo de talco – Mezcla de partículas finas (homogénea).
23. Detergente en agua – Solución homogénea de detergente (homogénea).
24. Mezcla de especias – Diferentes especias visibles (heterogénea).
25. Acero – Aleación de hierro y otros metales (homogénea).
26. Aceite de oliva – Mezcla homogénea de compuestos lipídicos (homogénea).
27. Masa para pizza – Mezcla de harina, agua y otros ingredientes (heterogénea).
28. Mezcla de pintura – Pigmentos y disolventes (homogénea).
29. Pulpa de café – Residuos visibles en el líquido (heterogénea).
30. Comida rápida – Varias partes visibles como lechuga, carne y pan (heterogénea).
Estas mezclas abarcan una variedad de contextos, desde la cocina hasta la ciencia, y representan tanto mezclas homogéneas como heterogéneas.
Galería
¿Qué es la Mezcla Homogénea?
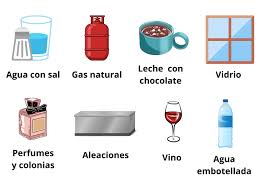
Son aquellas en las que los componentes están distribuidos de manera uniforme y no se pueden distinguir a simple vista. Ejemplo: agua con sal o el aire.
Ejemplos:
Aquí tienes una lista de ejemplos comunes de mezclas homogéneas, que son aquellas en las que sus componentes están uniformemente distribuidos y no se pueden distinguir a simple vista:
1. Agua salada – Solución de sal disuelta en agua.
2. Aire – Mezcla de gases como nitrógeno, oxígeno y dióxido de carbono.
3. Leche (homogeneizada) – Mezcla uniforme de agua, grasa y sólidos.
4. Alcohol etílico – Mezcla homogénea de etanol y agua.
5. Jarabe de azúcar – Solución de azúcar disuelto en agua.
6. Acero – Aleación homogénea de hierro y otros metales.
7. Bronce – Aleación de cobre y estaño.
8. Aluminio – Metal homogéneo utilizado en diversas aplicaciones.
9. Vino – Mezcla uniforme de agua, etanol y compuestos aromáticos.
10. Bebidas gaseosas – Mezcla de agua, azúcar y dióxido de carbono.
11. Cerveza – Mezcla de agua, lúpulo, cebada y levadura.
12. Solución de ácido clorhídrico – Cloruro de hidrógeno disuelto en agua.
13. Solución de amoníaco – Amoníaco disuelto en agua.
14. Solución de vinagre – Ácido acético disuelto en agua.
15. Soluciones de glucosa – Glucosa disuelta en agua.
16. Cemento – Mezcla homogénea de compuestos en polvo.
17. Mezcla de hormigón – Agua, cemento y agregados en una mezcla uniforme.
18. Gas natural – Mezcla de metano y otros hidrocarburos.
19. Aceite de motor – Mezcla homogénea de aceites y aditivos.
20. Jugo de naranja (sin pulpa) – Mezcla uniforme de jugo y agua.
21. Soluciones de cafeína – Cafeína disuelta en agua.
22. Solución de yodo – Yodo disuelto en agua o alcohol.
23. Solución de nitrato de sodio – Nitrato de sodio disuelto en agua.
24. Mezclas de pesticidas – Sustancias químicas disueltas en solventes.
25. Solución de azúcar en leche – Azúcar disuelto en leche.
26. Soluciones de sales minerales – Minerales disueltos en agua.
27. Aceite de oliva – Mezcla homogénea de compuestos lipídicos.
28. Solución de colorante – Colorante disuelto en agua.
29. Gel de aloe vera – Mezcla homogénea de compuestos en gel.
30. Solución de detergente – Detergente disuelto en agua.
Estas mezclas son homogéneas porque sus componentes se distribuyen de manera uniforme, creando una única fase que no se puede distinguir visualmente.
Galería
¿Qué es la Mezcla Heterogénea?
Ejemplos:
Aquí tienes una lista de ejemplos comunes de mezclas heterogéneas, que son aquellas en las que sus componentes son visibles y no están uniformemente distribuidos:
1. Ensalada – Mezcla de verduras y otros ingredientes.
2. Mezcla de arena y grava – Común en la construcción.
3. Aceite y agua – No se mezclan, formando dos capas.
4. Sopa de fideos – Fideos y caldo son claramente visibles.
5. Granito – Rocas compuestas por varios minerales visibles.
6. Gasoil y agua – Separación de dos líquidos no miscibles.
7. Tierra – Mezcla de minerales, materia orgánica y agua.
8. Piedras y tierra – Mezcla utilizada en jardinería.
9. Bolsitas de té en agua – La bolsa de té es visible y separable.
10. Nieve y tierra – Combinación en climas fríos.
11. Concreto – Mezcla de cemento, agua, arena y grava.
12. Mezcla de frutos secos – Diferentes tipos de nueces y semillas.
13. Barro – Mezcla de agua y tierra.
14. Hielo en refresco – Cubitos de hielo flotando en líquido.
15. Cereal con leche – Los trozos de cereal son visibles en la leche.
16. Bolsas de plastico y agua – Plásticos flotando en agua.
17. Fango – Mezcla de agua y partículas sólidas.
18. Arena y sal – Diferentes partículas visibles.
19. Jugo de pulpa de fruta – La pulpa es visible y separable.
20. Leche no homogeneizada – Capas de crema visibles en la superficie.
21. Batido de frutas con trozos – Trozos de fruta son visibles en la mezcla.
22. Cemento y agua – Mezcla en la construcción que no es uniforme.
23. Sopa de verduras – Trozos de vegetales son claramente visibles.
24. Mezcla de especias – Diferentes especias que se pueden distinguir.
25. Pulpa de café – Residuos visibles en el líquido.
26. Mezcla de arena y azúcar – Granos visibles y separables.
27. Gelatina con frutas – Trozos de fruta visibles en la gelatina.
28. Leche de almendras casera – Partículas de almendra no disueltas.
29. Aceite de oliva y vinagre – Capas visibles en un aderezo.
30. Arena y piedras – Composición de materiales en un área de construcción.
Estas mezclas son caracterizadas por la heterogeneidad de sus componentes, lo que significa que cada uno puede ser identificado y separado físicamente.
Galería
¿Qué es un Compuestos?
Un compuesto es una sustancia formada por la unión química de dos o más elementos diferentes en proporciones fijas y definidas. A diferencia de las mezclas, en los compuestos los elementos que lo conforman se combinan mediante enlaces químicos, lo que da lugar a nuevas propiedades diferentes de las de los elementos originales.
Por ejemplo, el agua (H₂O) es un compuesto formado por dos átomos de hidrógeno y uno de oxígeno. Estos elementos, cuando se combinan químicamente, producen una sustancia con propiedades distintas de las del hidrógeno y el oxígeno por separado.
Los compuestos solo pueden separarse en sus elementos originales mediante reacciones químicas, no por métodos físicos como ocurre en las mezclas.
Ejemplos:
Aquí tienes una lista de ejemplos comunes de compuestos químicos, que son sustancias formadas por la combinación de dos o más elementos en proporciones fijas:
1. Agua (H₂O) – Compuesto esencial para la vida.
2. Dióxido de carbono (CO₂) – Gas producido por la respiración y la combustión.
3. Ácido clorhídrico (HCl) – Ácido fuerte utilizado en procesos industriales y en el estómago.
4. Sulfato de sodio (Na₂SO₄) – Usado en detergentes y productos de limpieza.
5. Bicarbonato de sodio (NaHCO₃) – Usado en cocina y como antiácido.
6. Cloruro de sodio (NaCl) – Sal de mesa común.
7. Ácido sulfúrico (H₂SO₄) – Ácido fuerte utilizado en baterías y procesos químicos.
8. Glucosa (C₆H₁₂O₆) – Azúcar simple esencial para la energía celular.
9. Etanol (C₂H₅OH) – Alcohol utilizado en bebidas y como disolvente.
10. Acetona (C₃H₆O) – Disolvente común en productos de limpieza y esmaltes de uñas.
11. Ácido acético (C₂H₄O₂) – Componente del vinagre.
12. Fosfato de calcio (Ca₃(PO₄)₂) – Usado en fertilizantes y suplementos.
13. Amoniaco (NH₃) – Usado en limpieza y como fertilizante.
14. Ácido cítrico (C₆H₈O₇) – Usado como conservante y saborizante.
15. Sulfato de cobre (CuSO₄) – Usado en agricultura como fungicida.
16. Nitrato de potasio (KNO₃) – Usado como fertilizante y en fuegos artificiales.
17. Peróxido de hidrógeno (H₂O₂) – Usado como desinfectante y blanqueador.
18. Carbonato de calcio (CaCO₃) – Componente de la cal, usado en construcción.
19. Cloruro de potasio (KCl) – Usado como sustituto de sal.
20. Ácido fórmico (HCOOH) – Usado en productos de limpieza y conservantes.
21. Tiosulfato de sodio (Na₂S₂O₃) – Usado en fotografía y en procesos de desintoxicación.
22. Sacarosa (C₁₂H₂₂O₁₁) – Azúcar común utilizado como edulcorante.
23. Acido ascorbico (C₆H₈O₆) – Vitamina C, usada en suplementos.
24. Polipropileno (C₃H₆) – Polímero utilizado en plásticos.
25. Aguarrás (mezcla de hidrocarburos) – Usado como disolvente en pinturas.
26. Ftalato de dibutilo (DBP) – Usado como plastificante.
27. Poliestireno (C₈H₈) – Usado en envases y aislamiento.
28. Nitruro de silicio (Si₃N₄) – Usado en la industria electrónica y como material cerámico.
29. Sulfuro de hidrógeno (H₂S) – Gas tóxico con olor a huevo podrido.
30. Cetonas – Compuestos orgánicos que contienen un grupo carbonilo (R-CO-R').
Estos compuestos son fundamentales en diversas áreas como la biología, la química, la medicina y la industria, y tienen múltiples aplicaciones prácticas.
Galería
¿Qué son los Elementos?
En química, un elemento es una sustancia pura que no puede descomponerse en otras más simples mediante reacciones químicas. Está compuesto por átomos de un solo tipo, que se caracterizan por tener el mismo número de protones en su núcleo, conocido como número atómico. Ejemplos de elementos incluyen el hidrógeno (H), el oxígeno (O) y el hierro (Fe).
En otros contextos, como en matemáticas o informática, un elemento puede referirse a una parte o componente de un conjunto, lista, o estructura. Por ejemplo, en un conjunto de números, cada número es un elemento de ese conjunto.
Ejemplos:
Aquí tienes una lista de ejemplos comunes de elementos químicos, que son sustancias puras que no pueden descomponerse en sustancias más simples:
1. Hidrógeno (H) – Gas ligero y el elemento más abundante en el universo.
2. Helio (He) – Gas noble utilizado en globos y aplicaciones criogénicas.
3. Litio (Li) – Metal ligero utilizado en baterías recargables.
4. Berilio (Be) – Metal usado en aleaciones y componentes electrónicos.
5. Boro (B) – Usado en la fabricación de vidrios y como semiconductor.
6. Carbono (C) – Base de la química orgánica; presente en todas las formas de vida.
7. Nitrógeno (N) – Gas esencial en la atmósfera y parte de aminoácidos y proteínas.
8. Oxígeno (O) – Gas necesario para la respiración de la mayoría de los organismos.
9. Fluor (F) – Gas reactivo usado en productos de higiene dental.
10. Neón (Ne) – Gas noble utilizado en letreros luminosos.
11. Sodio (Na) – Metal alcalino utilizado en sales y en la industria.
12. Magnesio (Mg) – Metal ligero utilizado en aleaciones y fuegos artificiales.
13. Aluminio (Al) – Metal ampliamente utilizado en envases y estructuras.
14. Silicio (Si) – Elemento clave en la industria electrónica y en la fabricación de vidrio.
15. Fósforo (P) – Importante en fertilizantes y biología.
16. Azufre (S) – Usado en la fabricación de ácidos y productos químicos.
17. Cloro (Cl) – Gas utilizado en la desinfección de agua y productos químicos.
18. Argón (Ar) – Gas noble usado en soldadura y como atmósfera protectora.
19. Potasio (K) – Metal alcalino importante en fertilizantes.
20. Calcio (Ca) – Mineral esencial para los huesos y en la industria.
21. Escandio (Sc) – Usado en aleaciones y en la industria aeroespacial.
22. Titanio (Ti) – Metal resistente y ligero utilizado en implantes y aviación.
23. Cromo (Cr) – Usado en acero inoxidable y como pigmento.
24. Manganeso (Mn) – Importante en la fabricación de acero y baterías.
25. Hierro (Fe) – Metal fundamental en la construcción y fabricación de acero.
26. Cobalto (Co) – Usado en imanes y aleaciones.
27. Cobre (Cu) – Metal utilizado en cables eléctricos y tuberías.
28. Zinc (Zn) – Usado en galvanización y en la fabricación de aleaciones.
29. Plomo (Pb) – Metal pesado utilizado en baterías y protección radiológica.
30. Oro (Au) – Metal precioso utilizado en joyería y electrónica.
Estos elementos son fundamentales en la química y tienen diversas aplicaciones en la vida diaria, la industria y la ciencia.
Galería
¿Qué es el Soluto?
El soluto es la sustancia que se disuelve en un solvente para formar una solución. Es el componente presente en menor cantidad en una solución. Al disolverse, el soluto se dispersa uniformemente en el solvente, creando una mezcla homogénea.
Por ejemplo, en una solución de sal en agua, la sal es el soluto y el agua es el solvente. El soluto puede ser sólido, líquido o gas, dependiendo de la solución.
Ejemplos:
Aquí tienes una lista de ejemplos comunes de solutos que se utilizan en diversas disoluciones, desde la vida diaria hasta aplicaciones industriales:
1. Sal (cloruro de sodio) – Usada en la cocina y conservación de alimentos.
2. Azúcar (sacarosa) – Común en bebidas y alimentos.
3. Ácido cítrico – Usado como conservante y saborizante.
4. Bicarbonato de sodio – Usado en la cocina y limpieza.
5. Ácido acético – Componente del vinagre.
6. Almidón – Usado en alimentos y en la industria.
7. Glicerina – Usada en productos farmacéuticos y cosméticos.
8. Cafeína – Presente en café y bebidas energéticas.
9. Alcohol (etanol) – Usado en bebidas y productos de limpieza.
10. Medicamentos – Compuestos activos disueltos en soluciones (como jarabes).
11. Nitrato de potasio – Usado como fertilizante.
12. Fosfato de calcio – Usado en suplementos alimenticios.
13. Sulfato de cobre – Usado en agricultura como fungicida.
14. Cloruro de potasio – Usado como sustituto de sal en alimentos.
15. Propilenglicol – Usado en alimentos y productos cosméticos.
16. Ácido sulfúrico – Usado en procesos industriales.
17. Ácido clorhídrico – Usado en laboratorios y en la industria.
18. Cianuro de sodio – Usado en minería y en procesos químicos.
19. Polímeros – Como el polietileno, disueltos en ciertos solventes.
20. Nitrato de sodio – Usado en conservantes de alimentos.
21. Yodo – Usado en soluciones antisépticas.
22. Carbonato de sodio – Usado en detergentes y limpiadores.
23. Lactosa – Presente en productos lácteos.
24. Sustancias aromatizantes – Como la vainilla o el limón en bebidas.
25. Proteínas – Como la caseína en la leche.
26. Vitaminas – Como la vitamina C en soluciones efervescentes.
27. Esteroides – Usados en productos farmacéuticos.
28. Colorantes alimentarios – Disueltos en bebidas y alimentos.
29. Ácido ascórbico (vitamina C) – Usado en suplementos y alimentos.
30. Glucosa – Usada en bebidas energéticas y soluciones médicas.
Estos solutos son esenciales en una variedad de aplicaciones, desde la cocina hasta la medicina y la industria.
Galería
¿Qué es el Solvente?
El solvente es la sustancia en la que se disuelve el soluto para formar una solución. Generalmente, el solvente es el componente presente en mayor cantidad en la mezcla. El solvente tiene la capacidad de dispersar las partículas del soluto, creando una solución homogénea.
Por ejemplo, en una solución de sal en agua, el agua actúa como el solvente, y la sal como el soluto. El solvente puede ser sólido, líquido o gas, pero los solventes más comunes son líquidos, como el agua o el alcohol.
Ejemplos:
Aquí tienes una lista de ejemplos comunes de solventes que se utilizan en diversas aplicaciones, desde la vida diaria hasta la industria:
1. Agua – El disolvente universal.
2. Etanol – Usado en desinfectantes y bebidas alcohólicas.
3. Metanol – Usado en la fabricación de productos químicos.
4. Acetona – Común en quitaesmaltes y limpieza.
5. Benceno – Usado en la síntesis de productos químicos.
6. Tolueno – Usado en pinturas, disolventes y adhesivos.
7. Xileno – Usado en la disolución de resinas y pinturas.
8. Éter dietílico – Usado en laboratorios y como anestésico.
9. Cloroformo – Utilizado en la extracción de compuestos químicos.
10. Hexano – Usado en la extracción de aceites y grasas.
11. Ciclohexano – Usado en la síntesis química.
12. Dióxido de carbono (supercrítico) – Usado en la extracción de compuestos.
13. Ácido acético – Usado como disolvente y reactivo.
14. Propilenglicol – Utilizado en productos alimentarios y farmacéuticos.
15. Glicerina – Usada en cosméticos y productos farmacéuticos.
16. Tetracloruro de carbono – Usado en la industria química.
17. Aguarrás – Utilizado para diluir pinturas.
18. Disolventes de hidrocarburos – Usados en la fabricación de productos químicos.
19. Dimetil sulfoxido (DMSO) – Usado en medicina y como disolvente industrial.
20. Acetonitrilo – Utilizado en cromatografía y extracción.
21. Formamida – Usada en la síntesis química y como disolvente polar.
22. N-Butanol – Utilizado en la fabricación de productos químicos.
23. Etanolamina – Usada como disolvente y en la industria química.
24. Ácido fórmico – Usado en la industria y como disolvente.
25. Butil acetato – Usado en pinturas y lacas.
26. Nitrocelulosa – Usada en la fabricación de lacas y disolventes.
27. Disolventes de silicona – Utilizados en productos de sellado.
28. Alcohol isopropílico – Usado como desinfectante y limpiador.
29. Sustitutos de hidrocarburos – Usados como disolventes más seguros.
30. Disolventes polares – Usados en diversas aplicaciones químicas.
Estos solventes son esenciales en muchas industrias, desde la farmacéutica hasta la cosmética, y también se utilizan en el hogar.
Galería
¿Qué es el Disolvente?
Un disolvente es otra forma de referirse al solvente, que es la sustancia capaz de disolver un soluto para formar una disolución o solución. Es el medio en el que se dispersa el soluto, dando lugar a una mezcla homogénea.
El disolvente puede ser sólido, líquido o gas, aunque los más comunes son líquidos. Un ejemplo muy conocido es el agua, que es llamada el "disolvente universal" porque puede disolver muchas sustancias diferentes. Otros disolventes incluyen el alcohol y la acetona.
Ejemplos:
Aquí tienes ejemplos comunes de disolventes que se utilizan en la vida diaria, la industria y en aplicaciones científicas. Un disolvente es una sustancia, generalmente líquida, que disuelve a otra sustancia (el soluto) formando una solución:
1. Agua – El disolvente más común.
2. Etanol – Alcohol utilizado en bebidas y desinfectantes.
3. Metanol – Alcohol usado en solventes y productos industriales.
4. Acetona – Disolvente común en esmaltes de uñas y limpiadores.
5. Benceno – Disolvente aromático utilizado en la industria química.
6. Tolueno – Disolvente utilizado en pinturas y adhesivos.
7. Xileno – Usado en la disolución de resinas y pinturas.
8. Éter – Utilizado como disolvente en laboratorios químicos.
9. Cloroformo – Usado en laboratorios y en la extracción de compuestos.
10. Hexano – Usado como disolvente en extracción y en la industria alimentaria.
11. Ciclohexano – Disolvente utilizado en la síntesis química.
12. Dióxido de carbono (en estado supercrítico) – Usado como disolvente en extractos de cafeína.
13. Ácido acético – Usado como disolvente y reactivo en la industria.
14. Propilenglicol – Utilizado en la industria alimentaria y farmacéutica.
15. Glicerina – Usada en productos cosméticos y farmacéuticos.
16. Tetracloruro de carbono – Usado en la fabricación de productos químicos.
17. Agua destilada – Utilizada en aplicaciones donde se requiere alta pureza.
18. Solventes de hidrocarburos – Usados en la industria de pinturas y recubrimientos.
19. Aguarrás – Usado para diluir pinturas y limpiar brochas.
20. Disolventes de silicona – Usados en la formulación de productos de sellado.
21. Dimetil sulfoxido (DMSO) – Usado en medicina y como disolvente industrial.
22. Acetonitrilo – Usado en cromatografía y extracción de compuestos.
23. Formamida – Usada en la síntesis química y como disolvente polar.
24. N-Butanol – Usado en la fabricación de productos químicos.
25. Etanolamina – Utilizada como disolvente en procesos químicos.
26. Ácido fórmico – Usado en la industria y como disolvente.
27. Butil acetato – Utilizado en pinturas y lacas.
28. Nitrocelulosa – Usada en la fabricación de lacas y disolventes.
29. Sustitutos de hidrocarburos – Usados como disolventes más seguros.
30. Disolventes de cloruro de polivinilo (PVC) – Utilizados en la industria de plásticos.
Estos disolventes tienen una amplia variedad de aplicaciones en diferentes campos, como la química, la industria de la construcción, la farmacéutica y la cosmética.
Galería
¿Qué son las Sustancias puras?
Las sustancias puras son materiales que tienen una composición uniforme y constante, y que no pueden separarse en otros componentes mediante métodos físicos como filtración o destilación. Estas sustancias tienen propiedades físicas y químicas bien definidas, como el punto de fusión y el punto de ebullición.
Existen dos tipos de sustancias puras:
1. Elementos: Son sustancias puras formadas por un solo tipo de átomo, como el oro (Au), el oxígeno (O₂) o el hidrógeno (H₂).
2. Compuestos: Son sustancias puras formadas por la combinación química de dos o más elementos en proporciones fijas, como el agua (H₂O) o el dióxido de carbono (CO₂).
A diferencia de las mezclas, las sustancias puras tienen una composición fija que no varía.
Ejemplos:
Aquí tienes ejemplos comunes de sustancias puras que se encuentran en la vida diaria y en la naturaleza. Una sustancia pura es un material que tiene una composición uniforme y constante, y no se puede separar en otras sustancias por métodos físicos:
1. Agua destilada – Agua pura sin impurezas.
2. Sal de mesa (cloruro de sodio) – Compuesto químico puro.
3. Azúcar (sacarosa) – Carbohidrato puro.
4. Oro – Metal precioso en su forma pura (24 quilates).
5. Plata – Metal precioso en su forma pura.
6. Cobre – Metal en su estado puro.
7. Hidróxido de sodio (sosa cáustica) – Compuesto puro usado en limpieza.
8. Ácido clorhídrico – Solución pura de HCl en agua.
9. Amoníaco – Gas o solución pura de NH₃.
10. Bicarbonato de sodio – Compuesto químico puro (NaHCO₃).
11. Etanol – Alcohol en su forma pura.
12. Glicerina – Líquido viscoso puro (C₃H₈O₃).
13. Acido sulfúrico – Compuesto puro (H₂SO₄).
14. Diamante – Forma pura de carbono.
15. Grafito – Otra forma pura de carbono.
16. Helio – Gas noble puro.
17. Oxígeno – Gas puro (O₂).
18. Nitrógeno – Gas puro (N₂).
19. Argón – Gas noble puro.
20. Azufre – Elemento puro (S).
21. Fósforo – Elemento puro (P).
22. Cinc – Metal puro (Zn).
23. Mercurio – Metal líquido puro (Hg).
24. Fluor – Gas puro (F₂).
25. Acido acético – Compuesto puro (C₂H₄O₂) en forma concentrada.
26. Agua de cal – Hidróxido de calcio puro (Ca(OH)₂) disuelto en agua.
27. Cloro – Gas puro (Cl₂).
28. Aceros inoxidables – Aleación pura con proporciones específicas.
29. Soluciones concentradas de sal – Solución pura de NaCl en agua.
30. Sodio – Metal puro (Na).
Estos ejemplos representan diversas sustancias puras que tienen aplicaciones en la vida cotidiana, en la industria y en la investigación científica.
Galería
¿Qué es son las Soluciones?
Es una mezcla homogénea cuyos componentes, llamados soluto y solvente, no pueden ser separados por métodos mecánicos simples (filtración, decantación y centrifugación). Las soluciones verdaderas constan de un solvente y uno o varios solutos cuyas proporciones varían de una solución a otra.
Ejemplos
Aquí tienes ejemplos comunes de soluciones que se encuentran en la vida diaria, la naturaleza y en aplicaciones industriales. Una solución es una mezcla homogénea en la que un soluto se disuelve en un disolvente:
1. Agua salada – Sal disuelta en agua.
2. Azúcar en agua – Solución de azúcar y agua.
3. Alcohol etílico en agua – Solución de alcohol en agua (como en las bebidas alcohólicas).
4. Jugo de limón – Ácido cítrico disuelto en agua.
5. Bebidas gaseosas – Dióxido de carbono y azúcares disueltos en agua.
6. Té – Extractos de hojas de té disueltos en agua caliente.
7. Café – Componentes del café disueltos en agua caliente.
8. Vinagre – Ácido acético disuelto en agua.
9. Soda cáustica en agua – Hidróxido de sodio disuelto.
10. Lejía – Hipoclorito de sodio disuelto en agua.
11. Cloro en agua – Para la desinfección de piscinas.
12. Solución salina – Mezcla de cloruro de sodio y agua.
13. Sueros intravenosos – Mezclas de sales y azúcares disueltas en agua.
14. Solución de amoníaco – Amoníaco disuelto en agua.
15. Jarabe para la tos – Ingredientes activos disueltos en un líquido base.
16. Tinta – Colorantes disueltos en un solvente.
17. Pintura – Pigmentos y resinas disueltas en un disolvente.
18. Anticongelante – Mezcla de etilenglicol y agua.
19. Aguarrás – Disolvente de pinturas y productos de limpieza.
20. Mezcla de ácido sulfúrico – Ácido disuelto en agua (usado en baterías).
21. Glicerina – Solución viscosa utilizada en cosméticos.
22. Sulfato de cobre en agua – Solución utilizada como fungicida.
23. Agua de cal – Hidróxido de calcio disuelto en agua.
24. Solución de nitrato de plata – Utilizada en fotografía y medicina.
25. Solución de ácido clorhídrico – Disolución de HCl en agua (usada en laboratorios).
26. Aguja de nitrato de potasio en agua – Usada en fertilizantes.
27. Solución de ácido cítrico – Utilizada como conservante y saborizante.
28. Solución de etanol – Etanol disuelto en agua (usado en desinfectantes).
29. Solución de yodo – Iodopovidona disuelta en agua para desinfección.
30. Aguafuerte (ácido nítrico) – Disolución de ácido nítrico en agua.
Estos ejemplos incluyen soluciones líquidas que son comunes en la vida diaria, así como en aplicaciones industriales y científicas, mostrando la amplia utilidad de las soluciones en diversos contextos.
Galería
¿Qué es la Disolución?
Una disolución (o solución) es una mezcla homogénea formada por dos o más sustancias, en la que una o más (el soluto) se disuelven en otra (el disolvente). En una disolución, las partículas del soluto se dispersan de manera uniforme en el disolvente, creando una mezcla en la que no se pueden distinguir sus componentes a simple vista.
Las disoluciones pueden ser de distintos estados físicos:
Sólida: como una aleación de metales (ej. bronce).
Líquida: como la sal disuelta en agua.
Gaseosa: como el aire, que es una mezcla de varios gases.
Las disoluciones pueden variar en concentración (cantidad de soluto en el disolvente), y esto puede afectar sus propiedades físicas, como el punto de ebullición y la densidad.
Ejemplos:
Aquí tienes ejemplos comunes de disoluciones que se encuentran en la vida diaria, la naturaleza y en aplicaciones industriales. Una disolución es una mezcla homogénea en la que una sustancia (soluto) se disuelve en otra (disolvente):
1. Agua salada – Sal (soluto) disuelta en agua (disolvente).
2. Té – Sustancias solubles del té disueltas en agua caliente.
3. Café – Compuestos del café disueltos en agua caliente.
4. Agua azucarada – Azúcar disuelta en agua.
5. Jugo de frutas – Sustancias de la fruta disueltas en agua.
6. Refrescos – Dióxido de carbono y azúcares disueltos en agua.
7. Alcohol en agua – Alcohol etílico disuelto en agua (como en las bebidas alcohólicas).
8. Vinagre – Ácido acético disuelto en agua.
9. Aire – Mezcla de gases como oxígeno y nitrógeno disueltos en el aire.
10. Cloro en agua – Usado para desinfectar piscinas.
11. Anticongelante en agua – Etilenglicol disuelto en agua para motores de automóviles.
12. Gasolina con aditivos – Mezcla de hidrocarburos y aditivos disueltos.
13. Jugo concentrado en agua – Sustancias del jugo disueltas en agua.
14. Líquido de frenos – Mezcla de éteres disueltos en un líquido base.
15. Sueros médicos – Sales y azúcares disueltos en agua para aplicaciones intravenosas.
16. Amoniaco en agua – Usado como limpiador doméstico.
17. Alumbre en agua – Usado para clarificar agua o en medicina.
18. Detergente en agua – Componentes del detergente disueltos en agua para la limpieza.
19. Jarabe para la tos – Mezcla de ingredientes activos disueltos en un solvente.
20. Colonia o perfume – Fragancias disueltas en alcohol.
21. Acero inoxidable – Aleación sólida de hierro, níquel y cromo.
22. Alcohol isopropílico en agua – Usado como desinfectante.
23. Sosa cáustica en agua – Usado en limpieza de desagües.
24. Nitrato de plata en agua – Usado en medicina y fotografía.
25. Sulfato de cobre en agua – Usado como fungicida en agricultura.
26. Soda cáustica en agua – Usado en la industria química.
27. Cloruro de potasio en agua – Usado como fertilizante.
28. Oxígeno en agua – Para la respiración de organismos acuáticos.
29. Dióxido de carbono en agua – Usado en la fabricación de bebidas carbonatadas.
30. Aspirina en agua – Medicamentos disueltos para facilitar su ingesta.
Estos ejemplos abarcan una amplia gama de disoluciones tanto sólidas, líquidas como gaseosas, que son esenciales en la vida diaria y en múltiples industrias.
Galería
¿Qué es el Sólido?
Un sólido es un estado de la materia caracterizado por tener una forma y un volumen definidos. En los sólidos, las partículas (átomos, iones o moléculas) están estrechamente empaquetadas y organizadas en una estructura fija, lo que les confiere rigidez y estabilidad. Debido a esta disposición, los sólidos no se adaptan fácilmente a la forma del recipiente que los contiene.
Las principales características de los sólidos incluyen:
1. Forma definida: Mantienen su forma independientemente del recipiente.
2. Volumen constante: No se expanden ni se contraen significativamente con cambios de temperatura o presión.
3. Estructura interna ordenada: Las partículas en los sólidos están organizadas en patrones regulares (sólidos cristalinos) o desordenados (sólidos amorfos).
Los sólidos pueden clasificarse en dos categorías principales:
Sólidos cristalinos: Tienen una estructura interna ordenada y regular (ejemplo: sal, azúcar).
Sólidos amorfos: No tienen un patrón regular en su estructura (ejemplo: vidrio, plástico).
Además, los sólidos pueden ser metálicos, no metálicos, orgánicos o inorgánicos, dependiendo de su composición y propiedades.
Ejemplos:
Aquí tienes ejemplos comunes de sólidos que se encuentran en la vida diaria, la naturaleza y en aplicaciones industriales:
1. Roca – Común en la naturaleza, usada en construcción.
2. Madera – Usada en muebles, construcción y como combustible.
3. Hielo – Agua en estado sólido.
4. Hierro – Usado en estructuras, herramientas y maquinaria.
5. Oro – Metal precioso usado en joyería y electrónica.
6. Cobre – Metal usado en cables eléctricos y tuberías.
7. Aluminio – Usado en envases, transporte y construcción.
8. Vidrio – Usado en ventanas, botellas y recipientes.
9. Papel – Usado en escritura, impresión y embalaje.
10. Plástico – Material usado en envases, productos domésticos y juguetes.
11. Acero – Aleación usada en la construcción y fabricación de maquinaria.
12. Goma – Usada en neumáticos, gomas elásticas y aislantes.
13. Carbono – En forma de grafito (lápices) y diamante.
14. Ladrillo – Material de construcción para edificaciones.
15. Cemento – Usado para construir estructuras.
16. Sal de mesa (cloruro de sodio) – Usada como condimento y conservante.
17. Azúcar – Usado como endulzante.
18. Yeso – Usado en la construcción y en moldes médicos.
19. Arena – Utilizada en la construcción, vidriería y recreación.
20. Tierra – Base para plantas y construcción.
21. Hueso – Estructura de soporte en los animales.
22. Carbón – Usado como fuente de energía.
23. Arcilla – Usada para hacer cerámica y ladrillos.
24. Tela (algodón, lana, poliéster) – Usada para confeccionar ropa y textiles.
25. Lana – Usada para fabricar prendas de abrigo.
26. Galleta – Ejemplo de alimento sólido.
27. Mármol – Piedra utilizada en esculturas y construcción.
28. Chocolate – Producto alimenticio en estado sólido.
29. Poliestireno – Material sólido usado en embalajes y aislamiento.
30. Cera – Usada en velas y productos de cuidado personal.
Estos sólidos son fundamentales en la vida diaria y en diversas industrias debido a sus propiedades físicas que les permiten ser utilizados en múltiples aplicaciones.
Galería
¿Qué es el Líquido?
Un líquido es un estado de la materia que tiene un volumen definido, pero no una forma fija. Los líquidos adoptan la forma del recipiente que los contiene, fluyendo para llenar el espacio disponible.
Las características principales de los líquidos incluyen:
1. Volumen constante: Un líquido ocupa un volumen específico y no se comprime significativamente, incluso con cambios de presión.
2. Forma variable: Los líquidos no tienen una forma definida y pueden cambiar su contorno dependiendo del recipiente.
3. Fluidez: Los líquidos pueden fluir y se mueven fácilmente, lo que les permite tomar la forma del recipiente en el que están.
A nivel molecular, las partículas en un líquido están más separadas que en un sólido, pero más cercanas que en un gas. Esto permite que las partículas se deslicen unas sobre otras, lo que da al líquido su capacidad para fluir.
Los líquidos pueden ser clasificados en varias categorías, como:
Líquidos puros: Compuestos por una sola sustancia, como el agua destilada.
Soluciones: Mezclas homogéneas de un soluto y un disolvente, como el agua con sal.
Emulsiones: Mezclas de dos líquidos que normalmente no se mezclan, como el aceite y el agua.
Ejemplos:
Aquí tienes ejemplos comunes de líquidos que se encuentran en la vida diaria, la naturaleza y en aplicaciones industriales:
1. Agua – El líquido más común y vital para la vida.
2. Aceite de cocina – Usado en la preparación de alimentos.
3. Leche – Líquido nutritivo de origen animal o vegetal.
4. Jugo de frutas – Líquido extraído de frutas.
5. Sangre – Líquido corporal que transporta nutrientes y oxígeno.
6. Gasolina – Combustible utilizado en vehículos.
7. Alcohol etílico – Usado en bebidas alcohólicas y como desinfectante.
8. Vinagre – Líquido ácido usado en la cocina y limpieza.
9. Miel – Líquido viscoso producido por las abejas.
10. Sirope de arce – Líquido dulce derivado de la savia del arce.
11. Refrescos – Bebidas carbonatadas.
12. Té – Bebida a base de hojas infusionadas en agua.
13. Café – Bebida hecha a partir de granos de café infusionados.
14. Soluciones salinas – Usadas en medicina y laboratorios.
15. Mercurio – Metal líquido a temperatura ambiente.
16. Jabón líquido – Usado para la limpieza.
17. Champú – Líquido usado para lavar el cabello.
18. Salsa de tomate – Líquido viscoso usado como condimento.
19. Cloro líquido – Utilizado en la limpieza y desinfección.
20. Detergente líquido – Usado para lavar ropa y platos.
21. Petróleo crudo – Líquido natural utilizado como fuente de energía.
22. Anticongelante – Líquido utilizado en sistemas de refrigeración de motores.
23. Tinta – Líquido utilizado en impresoras y bolígrafos.
24. Jarabe para la tos – Líquido medicinal.
25. Glicerina – Líquido viscoso usado en productos cosméticos y farmacéuticos.
26. Lejía – Líquido limpiador y desinfectante.
27. Solvente de pintura – Usado para diluir o limpiar pinturas.
28. Colonia o perfume – Líquido aromático para uso personal.
29. Aceite de motor – Usado para lubricar motores.
30. Látex líquido – Usado en pinturas y productos de caucho.
Estos líquidos son esenciales en diversas actividades cotidianas y procesos industriales, cada uno con propiedades únicas que los hacen útiles en diferentes contextos.
Galería
¿Qué es el Gas?
Un gas es un estado de la materia que no tiene ni forma ni volumen definidos. A diferencia de los sólidos y líquidos, los gases se expanden para llenar completamente el recipiente que los contiene, adaptándose a su forma y tamaño.
Las características principales de los gases son:
1. Forma y volumen variables: Los gases no tienen una forma fija y ocupan todo el espacio disponible en un recipiente.
2. Baja densidad: Los gases son menos densos que los sólidos y líquidos, ya que las partículas están mucho más separadas entre sí.
3. Alta compresibilidad: Los gases pueden comprimirse fácilmente, lo que significa que su volumen puede disminuir significativamente bajo presión.
4. Movimiento libre de partículas: Las partículas en un gas se mueven rápidamente y se deslizan unas sobre otras, lo que les permite expandirse y ocupar el espacio disponible.
Los gases pueden clasificarse en diferentes categorías, como:
Gases ideales: Gases que siguen las leyes de los gases ideales en condiciones ideales de temperatura y presión.
Gases reales: Gases que no se comportan de manera ideal debido a interacciones intermoleculares y a las condiciones de presión y temperatura.
Ejemplos comunes de gases incluyen el oxígeno (O₂), el dióxido de carbono (CO₂), el nitrógeno (N₂) y el helio (He).
Ejemplos:
Aquí tienes ejemplos comunes de gases que encontramos en la vida cotidiana, la atmósfera y en diversas aplicaciones industriales:
1. Oxígeno (O₂) – En el aire que respiramos.
2. Nitrógeno (N₂) – El gas más abundante en la atmósfera.
3. Dióxido de carbono (CO₂) – Producto de la respiración y la combustión.
4. Monóxido de carbono (CO) – Gas tóxico producido por la quema incompleta de combustibles.
5. Hidrógeno (H₂) – Utilizado en industrias y como posible combustible.
6. Helio (He) – Gas ligero usado en globos y equipos de buceo.
7. Metano (CH₄) – Principal componente del gas natural.
8. Propano (C₃H₈) – Usado como combustible en calentadores y estufas.
9. Butano (C₄H₁₀) – Gas utilizado en encendedores y estufas portátiles.
10. Ozono (O₃) – Gas que forma la capa de ozono en la atmósfera.
11. Argón (Ar) – Gas inerte usado en soldadura y en bombillas.
12. Neón (Ne) – Gas usado en luces de neón.
13. Amoníaco (NH₃) – Gas utilizado en fertilizantes y productos de limpieza.
14. Cloro (Cl₂) – Gas tóxico usado en la purificación de agua.
15. Hexafluoruro de azufre (SF₆) – Gas usado como aislante en equipos eléctricos.
16. Dióxido de azufre (SO₂) – Producto de la quema de combustibles fósiles y causante de lluvia ácida.
17. Gas natural – Mezcla de metano y otros hidrocarburos usado como combustible.
18. Hidrógeno sulfuroso (H₂S) – Gas con olor a huevos podridos, común en procesos industriales.
19. Vapor de agua (H₂O) – Agua en estado gaseoso en la atmósfera.
20. Freón – Nombre comercial para gases refrigerantes.
21. Radón (Rn) – Gas radiactivo presente en algunas áreas geológicas.
22. Dióxido de nitrógeno (NO₂) – Gas resultante de la combustión de combustibles fósiles.
23. Xenón (Xe) – Gas usado en luces de alta intensidad.
24. Trifluoruro de boro (BF₃) – Usado como catalizador en la industria.
25. Etano (C₂H₆) – Componente del gas natural y petroquímicos.
26. Óxido nitroso (N₂O) – Gas usado como anestésico (gas de la risa) y en motores de alta potencia.
27. Etileno (C₂H₄) – Gas utilizado en la industria de plásticos y para madurar frutas.
28. Monóxido de dinitrógeno (N₂O) – Usado como anestésico en medicina.
29. Acetileno (C₂H₂) – Gas utilizado en soldadura.
30. Gas de carbón – Mezcla de gases obtenidos de la destilación del carbón, utilizado en alumbrado en el pasado.
Estos gases tienen una amplia gama de aplicaciones y propiedades, desde su uso en la atmósfera hasta en la industria y la vida cotidiana.
Galería
¿Qué es el Plasma?
El plasma es un estado de la materia que se forma cuando un gas se ioniza, es decir, cuando las partículas que lo componen (átomos o moléculas) se calientan a temperaturas extremadamente altas o se someten a campos eléctricos o magnéticos. Esto provoca que los electrones se separen de los núcleos, creando un conjunto de iones positivos y electrones libres.
Las características principales del plasma son:
1. Conductividad eléctrica: El plasma es un buen conductor de electricidad debido a la presencia de partículas cargadas (iones y electrones).
2. Respuesta a campos eléctricos y magnéticos: Los plasmas pueden ser influenciados por campos eléctricos y magnéticos, lo que les permite ser manipulados y controlados.
3. Emisión de luz: Cuando los electrones en un plasma vuelven a unirse con los iones, liberan energía en forma de luz, lo que resulta en fenómenos como los relámpagos o las auroras boreales.
4. Alta energía: Los plasmas generalmente tienen temperaturas muy altas y son menos densos que los líquidos y sólidos.
El plasma se encuentra en muchas situaciones naturales y artificiales, tales como:
Naturales: Estrellas, incluyendo el Sol, que están compuestas principalmente de plasma. También las auroras boreales y los rayos son ejemplos de plasma en la naturaleza.
Artificiales: En lámparas fluorescentes, pantallas de plasma y en ciertas aplicaciones industriales, como la soldadura por plasma.
El plasma es considerado el cuarto estado de la materia, además de los sólidos, líquidos y gases.
Ejemplos:
El plasma es uno de los cuatro estados de la materia, junto con el sólido, líquido y gas. Es un gas ionizado compuesto por electrones y iones cargados, lo que le da propiedades únicas como conducir electricidad y ser afectado por campos magnéticos.
A continuación te enlisto ejemplos comunes de plasmas:
1. Relámpagos
2. Auroras boreales
3. Llamas (ciertos tipos de fuego)
4. Sol (y otras estrellas)
5. Nebulosas (nubes de gas ionizado en el espacio)
6. Pantallas de plasma (televisores y monitores)
7. Lámparas de neón (los gases en su interior se ionizan para emitir luz)
8. Lámparas fluorescentes
9. Corte por plasma (utilizado en procesos industriales)
10. Tormentas de polvo espacial
11. Corona solar (la atmósfera externa del sol)
12. Viento solar
13. Chorros de plasma en galaxias activas
14. Descargas eléctricas en gases (como las de los experimentos de Tesla)
15. Fusión nuclear controlada (como en reactores de fusión experimental)
16. Auroras australes
17. Chorros relativistas (en agujeros negros)
18. Plasma en la ionosfera terrestre
19. Gases ionizados en motores de cohetes iónicos
20. Plasma de laboratorio (utilizado en experimentos científicos)
21. Tormentas de plasma en la magnetósfera de la Tierra
22. Interacciones de plasma en el espacio interestelar
23. Burbujas de plasma generadas por explosiones nucleares
24. Magneto esferas planetarias (como la de Júpiter)
25. Plasma en discos de acreción alrededor de estrellas o agujeros negros
26. Arcos eléctricos (como los usados en soldadura por arco)
27. Descargas de corona en torres eléctricas
28. Plasma en simulaciones de energía de fusión
29. Plasma en el interior de reactores Tokamak
30. Reacciones de plasma en la atmósfera de planetas extraterrestres
El plasma es el estado de la materia más común en el universo (alrededor del 99 % de la materia visible), ya que las estrellas y gran parte del espacio interestelar están en este estado. En la Tierra, aunque es menos común de manera natural, se puede observar en fenómenos eléctricos y en aplicaciones tecnológicas.
Galería
¿Qué son los Coloides?
Los coloides son mezclas heterogéneas en las que una o más sustancias microscópicas están dispersas de manera uniforme en otra sustancia, sin llegar a disolverse por completo. Las partículas dispersas en un coloide tienen un tamaño intermedio entre las de una solución verdadera y las de una suspensión, generalmente entre 1 y 1000 nanómetros. Estas partículas son lo suficientemente grandes para dispersar la luz (efecto Tyndall), pero lo suficientemente pequeñas para no sedimentarse fácilmente.
Ejemplos comunes de coloides incluyen la leche (dispersiones de grasa en agua), la gelatina y el humo.
Ejemplos:
Aquí tienes ejemplos comunes de coloides clasificados según el tipo de dispersión:
1. Aerosoles (sólido o líquido en gas):
1. Niebla (gotas de agua en aire)
2. Aerosol de desodorante (gotas de líquido en aire)
3. Humo (partículas sólidas en aire)
4. Polvo en suspensión (sólido en aire)
5. Spray para el cabello (líquido en aire)
2. Espumas (gas en líquido o sólido):
6. Espuma de afeitar (gas en líquido)
7. Crema batida (gas en líquido)
8. Nube (gas en agua)
9. Pan de levadura (gas en sólido)
10. Espuma de poliuretano (gas en sólido)
3. Emulsiones (líquido en líquido):
11. Leche (grasa en agua)
12. Mayonesa (aceite en agua)
13. Mantequilla (agua en grasa)
14. Crema hidratante (aceite en agua)
15. Vinagreta (aceite en vinagre, si está bien mezclada)
4. Geles (sólido en líquido):
16. Gelatina (proteína en agua)
17. Pasta de dientes (sólido en líquido)
18. Agar-agar (polisacárido en agua)
19. Crema para la piel (emulsión de sólidos en agua)
20. Flan (proteínas en agua)
5. Soles (sólido en líquido):
21. Tinta (pigmento en agua)
22. Pintura de emulsión (pigmento en líquido)
23. Sangre (células y proteínas en agua)
24. Barro (sólidos en agua)
25. Almidón en agua (almidón en líquido)
6. Espumas sólidas (gas en sólido):
26. Corcho (gas en sólido)
27. Chocolate aireado (gas en sólido)
28. Lava solidificada (gas en roca)
29. Vidrio poroso (gas en vidrio)
30. Panal (gas en cera)
Estos ejemplos abarcan una amplia gama de aplicaciones y formas de coloides que encontramos en la vida diaria.
Galería
¿Qué son las Suspensiones?
Las suspensiones son mezclas heterogéneas en las que partículas sólidas relativamente grandes (mayores de 1 micrómetro) se dispersan en un líquido o gas, pero no se disuelven. A diferencia de los coloides o las soluciones, las partículas en una suspensión son lo suficientemente grandes como para sedimentarse con el tiempo debido a la gravedad, lo que significa que la mezcla tiende a separarse si se deja en reposo.
Un ejemplo típico de suspensión es el agua con arena, donde las partículas de arena eventualmente se depositan en el fondo. Las suspensiones también pueden aparecer turbias o opacas, ya que las partículas dispersas pueden bloquear la luz. Para mantener una suspensión homogénea durante un tiempo más largo, suele ser necesario agitarla o mantenerla en movimiento.
Ejemplos:
Aquí tienes ejemplos comunes de suspensiones que se encuentran en la vida diaria:
1. Arena en agua
2. Barro en agua
3. Harina en agua
4. Talco en agua
5. Pintura de látex
6. Polvo de tiza en agua
7. Leche de magnesia
8. Jugo de naranja con pulpa
9. Antibióticos en suspensión (como la amoxicilina líquida)
10. Arcilla en agua
11. Carbón activado en agua
12. Café molido en agua (antes de colar)
13. Polvo de cacao en leche (antes de disolverse)
14. Polvo de canela en agua
15. Almidón en agua fría
16. Chocolate caliente no homogeneizado
17. Levadura en agua
18. Aerosoles de polvo (como en los ambientes con polución)
19. Polvo de mármol en agua
20. Medicamentos en suspensión (como algunos antiácidos)
21. Sulfato de bario en agua (para radiografías)
22. Polvo de grafito en aceite
23. Cenizas volcánicas en aire
24. Maicena en agua
25. Jabón en polvo en agua
26. Cobre en polvo en agua
27. Cal en agua (agua de cal)
28. Óxido de hierro en aceite
29. Polvo de oro en agua (utilizado en minería)
30. Polen en agua o aire
En todas estas suspensiones, las partículas sólidas dispersas no se disuelven y, con el tiempo, tienden a sedimentarse si no se agitan o mantienen en movimiento.
Galería
.





















































.png)
No comments:
Post a Comment